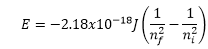6.33 Cuando ocurren las siguientes transiciones electrónicas
en el átomo de hidrógeno, ¿se absorbe o se emite energía?(a) de n = 4 a n = 2, (b)
de un orbital de radio 2.12 Å a uno de radio 8.46 Å, (c)
un electrón se adhiere al ion H+ y termina en la capa n = 3?
(a) Emite energía
(b)Absorbe energía
(c)Emite Energía
6.34 Indique si se absorbe o se
emite energía cuando ocurren las siguientes transiciones electrónicas en el
átomo de hidrógeno (a) de n = 2 a n = 6 , (b) de una órbita de radio 4.76 Á a
una de radio 0529 Á, (c) del estado n = 6a n
= 9.
(a) Absorbe
(b)Emite
(c)Emite
(a) Para n=2 y n=6


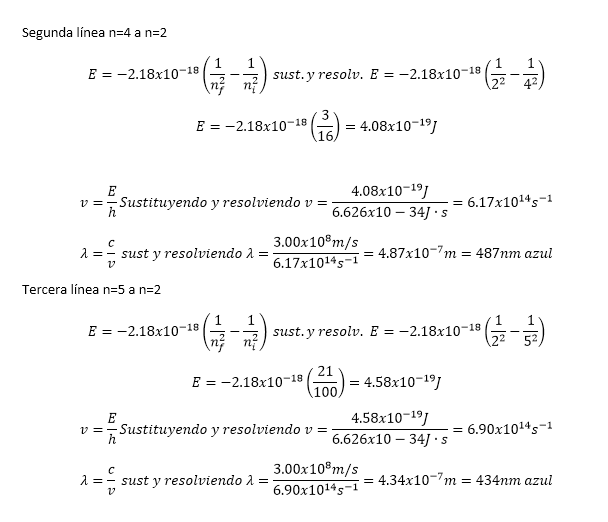



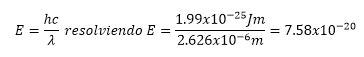
6.35(a) Mediante el uso de la
ecuación 6 5, calcule la energía de un electrón en el átomo de hidrógeno cuando
n = 2y cuando n = 6. Calcule la longitud de onda de la radiación liberada cuando
el electrón se mueve de n = 6 a n = 2. ¿Está la línea en la región visible del
espectro electromagnético? Si es así, ¿de qué color es? (b) Calcule las energías
de un electrón en el átomo de hidrógeno para n = 1 y para n = (∞).
De acuerdo con Bohr, ¿cuánta energía se requiere para mover un electrón completamente
fuera del átomo (de n = 1 a n = ∞)? Escriba su respuesta en kj/mol. (c)
A la energía para el proceso H + energía àH+
+ e- se le conoce como energía de ionización del hidrógeno. El valor
de la energía de ionización del hidrógeno determinado experimentalmente es 1310
kj/mol. ¿Cómo se compara esto con su cálculo?
(a) Para n=2 y n=6

6.36 Para cada uno de los
siguientes transiciones electrónicas en el átomo de hidrógeno, calcule la energía,
frecuencia y longitud de onda de la radiación asociada, y determine si la radiación
se emite o se absorbe durante la transición:(a) de n = 4 a n = 1, (b) de n = 5
a n = 2, (c) de n = 3 a n = 6. ¿Alguna de estas transiciones absorbe o emite luz
visible?






6.37 Todas las líneas
de emisión visibles observadas por Balmer involucraban a nf = 2. (a)
Explique por qué sólo se observaron en la región visible del espectro
electromagnético las líneas con nf = 2. (b) Calcule las longitudes de
onda de las tres primeras líneas en la serie de Balmer (aquellas para las que ni
= 3, 4 y 5) e identifique estas líneas en el espectro de emisión que aparece en
la figura 6.13.
a). Se observan en la región
visible porque de acuerdo la frecuencia y longitud calculada caen dentro del
rango visible 400 a 700 nm como se observan en los siguientes ejemplos.

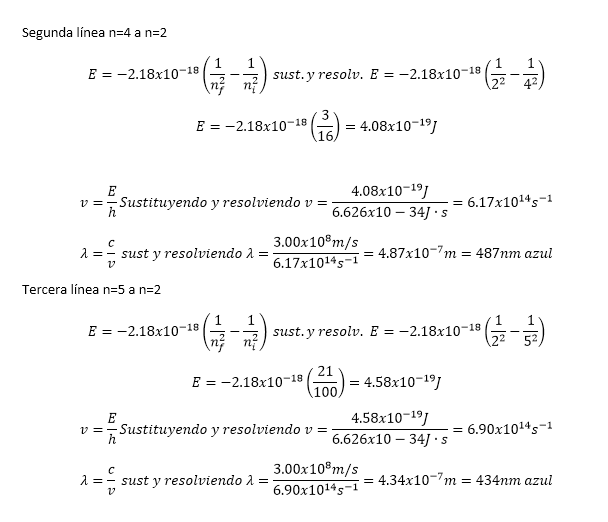
6.38 La serie de Lyman
de las líneas de emisión del átomo de hidrógeno son aquellas en las cuales nf=
1. (a) Determine la región del espectro electromagnético en la que se pueden observar
las líneas de la serie de Lyman. (b) Calcule las longitudes de onda de las tres
primeras líneas en la serie de Lyman (aquellas para las cuales ni=
2,3 y 4.
(a) De acuerdo a la
longitud de onda caen dentro del rango ultravioleta.


6.39 Una de las líneas
de emisión del átomo de hidrógeno tiene una longitud de onda de 93.8 nm. (a)
¿En qué región del espectro electromagnético se encuentra esta emisión? (b)
Determinó los valores inicial y final de n asociados con esta emisión.
(a) Ultravioleta.

6.40El átomo de
hidrógeno puede absorber luz con una longitud de onda de 2626 nm. (a) ¿En qué
región del espectro electromagnético se encuentra esta absorción? (b) Determine
los valores inicial y final de n asociados con esta absorción.
(a) Infrarrojo
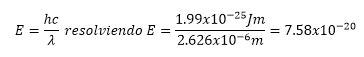
De acuerdo al valor de
la energía para la longitud de onda dada n tiene que ser un número mayor a 1,
en este caso lo calcule sustituyendo lo valores de n a partir de n=3 Sin
embargo los valores que obtuve fue de ni=4 y nf=6 y como
se predice en el valor de la energía los valores de n estarían separados del núcleo.