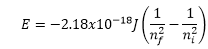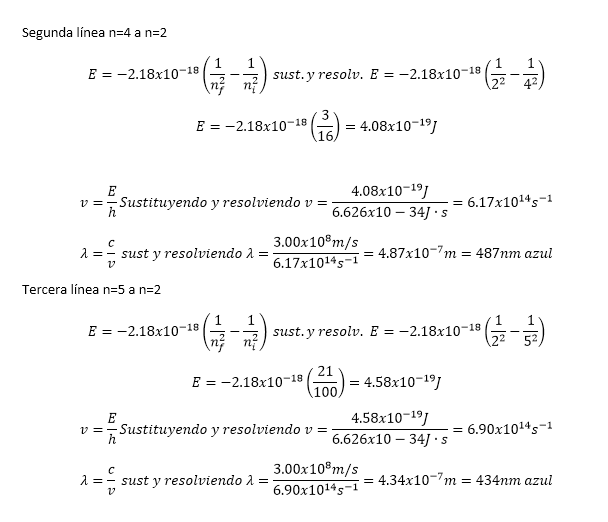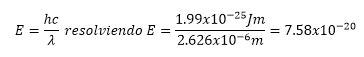Mecánica Cuántica y orbitales
atómicos:
Con estos ejercicios termino la seccion de Estructura electronica de los átomos.
6.49 (a) Para n = 4, ¿Cuáles son
los valores posibles de I? (b) Para I = 2, ¿cuáles son los valores posibles
de ml (c) Si ml es igual a 2, ¿cuáles son
los valores posibles de l?
(a) n= 4 àl=0, 1, 2, 3
(b) l=2 à ml= 2, 1, 0, -1, -2
(c) ml=2àl=2 o mayor a 2
6.50 ¿Cuántos valores posibles
existen para l y ml cuando(a) n= 3; (b) n= 5?
(a) n=3 para l=0, 1, 2 y ml=
2, 1, 0, -1, -2
(b) n=5 para l=0, 1, 2, 3, 4 y ml=
4, 2, 1, 0, -1, -2, -3, -4
6.51 Escriba los valores
numéricos de n y l que corresponden a
cada una de las siguientes designaciones de orbitales:(a) 3p, (b) 2s, (c) 4f, (d)
5d
(a) 3p para n=3 y l=1
(b) 2s para n=2 y l=0
(c) 4f para n= 4 y l = 3
(d) 5d para n=5 y l= 2
6.52 Escriba el valor de n, l y ml
para (a) cada orbital en la subcapa 2p,(b) cada orbital en la subcapa 5d
(a) 2p n=2, l=1 y ml=-1,
0, 1
(b) 5d n=5, l=2 y ml=-2,
-1, 0, 1, 2
6.53 ¿Cuál de los siguientes
casos representa una combinación imposible de n y l: (a) 1p, (b) 4s, (c) 5f, (d) 2d?
(a) 1p imposible
(b) 4s posible
(c) 5f posible
(d) 2d imposible
6.54 Para la tabla que aparece a
continuación, escriba qué orbital corresponde al número cuántico. No se preocupe
por los subíndices x, y, z. Si no están permitidos los números cuánticos,
escriba "no permitido".
n
|
l
|
ml
|
Orbital
|
2
|
1
|
-1
|
2p (ejemplo)
|
1
|
0
|
0
|
1s
|
3
|
-3
|
2
|
No permitido
|
3
|
2
|
-2
|
3d
|
2
|
0
|
-1
|
No permitido
|
0
|
0
|
0
|
No permitido
|
4
|
2
|
1
|
4f
|
5
|
3
|
0
|
5d
|
Átomos polielectrónicos y
configuraciones electrónicas.
00de070be2d6
6.59 Para un valor dado del
número cuántico principal, n, ¿cómo varía la energía de las subcapas s, p, d y
f para(a) el hidrógeno, (b) un átomo polielectrónico?
(a) Para el Hidrogeno en estado
basal la energía seria la misma, mientras que para (b) a hay mayor energía
conforme al número de capas.
6.60 (a) la distancia promedio
desde el núcleo de un electrón en 3s en un átomo de cloro es más pequeña que
aquella para un electrón en 3p. Según este hecho, ¿cuál es el orbital con más
energía? (b) ¿Se requerirá más o menos
energía para remover un electrón en 3s en el átomo de cloro, en comparación con
el electrón en 2p? Explique su respuesta
(a) 3p > 3s
(b)Se requiere menos energía para
el electrón en 3s ya que esta se encuentra en otro nivel de energía y por consiguiente
está separado del núcleo.
6.61 (a) ¿Qué evidencia
experimental existe para comprobar que el electrón tiene un "espín"?
(b) Dibuje un diagrama de niveles de energía que muestre la posiciones
energéticas posibles de un orbital 1s y un orbital 2s.Coloque dos electrones en
el orbital 1s. (c) Dibuje una flecha que muestre la excitación de un electrón
desde el orbital 1s al orbital 2s.
(a) En 1921, Otto Stem y Walter
Gerlach tuvieron éxito al separar un haz de átomos neutros en dos grupos
pasándolos a través de un campo magnético no homogéneo. Supongamos que
utilizaron un haz de átomos de hidrógeno (en realidad, utilizaron átomos de
plata, los cuales contienen sólo un electrón desapareado). Normalmente
esperaríamos que los átomos neutros no se vieran afectados por un campo
magnético. Sin embargo, el campo magnético que surge del espín del electrón
interactúa con el campo del imán, y desvía al átomo de su trayectoria recta.
6.62 (a) Enuncie el principio de
exclusión de Pauli en sus propias palabras, (b) El principio de exclusión de
Pauli es, de manera importante, la clave para comprender la tabla periódica.
Explique por qué.
Explica que para cada átomo dos
de sus electrones no pueden tener el mismo conjunto de número cuánticos. Por
consiguiente solo pueden haber dos electrones para cada orbital.
Ya que se establece un orden en
los elementos que proviene del llenado de los orbitales s, p, d, f.
6.63 ¿Cuál es el número máximo de
electrones que pueden ocupar cada una de las siguientes subcapas: (a) 3p, (b)
5d, (c) 2s, (d) 4f?
(a) 6
(b) 10
(c) 2
(d) 14
6.64 ¿Cuál es el número máximo de
electrones en un átomo que pueden tener los siguientes números cuánticos: (a) n=
2, ms = -1/2, (b) n= 5, l= 3; (c) n =
4, l = 3, ml = -3; (d) n = 4, l=
1, ml = 1?
(a) 10
(b) 90
(c) 47
(d) 36
6.65 (a) ¿Qué son los
"electrones de valencia"? (b) ¿Qué son los "electrones
internos"? (c) ¿Qué representa cada cuadro en el diagrama de orbitales?
(d) ¿Qué cantidad representa la dirección (hada arriba o hacia abajo) de las
medias flechas en el diagrama de orbitales?
(a) Son los electrones de la capa
externa de los orbitales atómicos, en las que no se involucre el llenado
completo de los orbitales d y f y que además están involucrados en el enlace
químico.
(b) Son los electrones que
involucran al gas noble dentro de la configuración electrónica.
(c) Representa a los electrones.
(d)+1/2 y -1/2
6.66 Para cada elemento, cuente
el número de electrones de valencia, electrones internos y electrones
desapareados en el estado basal: (a) carbono, (b) fósforo, (c) neón.
(a) Carbono E.V.=4, E.I.=2
E.D. = 2
(b) Fosforo E.V.= 5 E.I.=10
E.D. =3
(c) Neón E.V. =0 E.I.=10 E.D. =0
6.67 Escriba las configuraciones
electrónicas abreviadas para los siguientes átomos utilizando las abreviaturas
apropiadas para gases nobles: (a) Cs, (b) Ni, (c) Se, (d) Cd, (e) U, (f) Pb.
(a) Cs: [Xe] 6s1
(b) Ni: [Ar] 3d8 4s2
(c) Se: [Ar] 3d10 4s2 4p4
(d) Cd: [Kr] 4d10 5s2
(e) U: [Rn] 5f3 6d1 7s2
(f) Pb: [Xe] 4f14 5d10 6s2
6p2
6.68 Escriba las configuraciones
electrónicas abreviadas para los siguientes átomos, e indique cuantos
electrones desapareados contiene cada uno: (a) Ga, (b) Ca, (c) V, (d) I, (e) Y,
(f) Pt, (g) Lu.
(a) Ga [Ar] 3d10 4s2
4p1 un electrón desapareado
(b) Ca [Ar] 4s2 Ningún
electrón desapareado
(c) V [Ar] 3d3 4s2
Tres electrones desapareados
(d) I [Kr] 4d10 5s2
5p5 un electrón desapareado
(e) Y [Kr] 3d1 5s2
un electrón desapareado
(f) Pt [Xe] 4f14 5d8
6s2 dos electrones desapareados
(g) Lu [Xe] 4f14 5d1
6s2 un electrón desapareado
6.69 Los iones también tienen
configuración electrónica (Sección 7.4). Los cationes contienen menos
electrones de valencia, y los aniones tienen más electrones de valencia, respectivamente,
que sus átomos neutros de los que se originan. Por ejemplo, el ion cloruro, Cl-,
tiene la siguiente configuración electrónica 1s2 2s2 2p63s2
3p6, para un total de 18 electrones, comparado con 17 para el cloro
neutro, el elemento. El Na tiene la siguiente configuración electrónica 1s2
2s2 2p6 3s1 pero el ion Na+ tiene
la siguiente configuración electrónica 1s2 2s2 2p6. Escriba las configuraciones
electrónicas para (a) F-, (b) I-, (c) O2-, (d)
K+, (e) Mg2+, (f) Al3+
(a) F- 1s2 2s2
2p6
(b) I- [Kr] 4d10 5s2
5p6
(c) O2- 1s2 2s2
2p6
(d) K+ [Ne] 3s2 3p6
(e) Mg2+ 1s2 2s2
2p6
(f) Al3+ 1s2 2s2
2p6